유한양행(대표 조욱제)이 면역항암제 신약으로 개발 중인 YH32364의 임상1/2상 시험계획(IND)을 식품의약품안전처(이하 식약처)로부터 승인, 기존 항체보다 더 광범위한 범위에 효과적인 치료제 개발에 나선다.
유한양행은 지난 7일 면역항암제로 개발 중인 신약 후보물질 ‘YH32364’에 대해 식약처로부터 임상 1/2상 시험계획(IND) 승인을 받았다고 밝혔다.
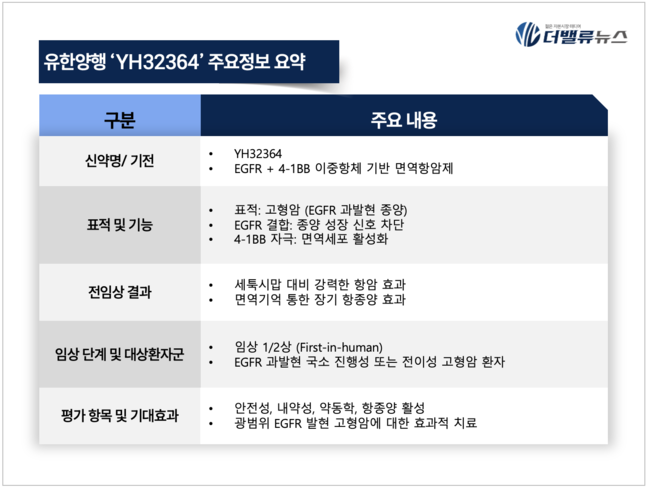
'YH32364'는 표피 성장인자 수용체(EGFR, epidermal growth factor receptor)와 면역 공동자극 수용체인 4-1BB(효과적인 T 세포(대표적인 종양 괴사 인자 (tumor necrosis factor:TNF) 수용체 계열의 공동 자극 수용체(co-stimulatory receptor)로서 활성화) 면역 반응을 유지하고 면역학적 기억을 생성하는데 중요한 역할을 담당)를 동시에 표적하는 이중항체 기반 치료제다. 암세포 표면의 EGFR에 결합해 성장신호를 차단하는 동시에, 4-1BB 신호를 통해 면역세포를 자극해 항암 효과를 유도하는 기전을 갖는다.
 유한양행의 신약 후보물질 'YH32364' 주요정보 요약 도표. [자료=더밸류뉴스]
유한양행의 신약 후보물질 'YH32364' 주요정보 요약 도표. [자료=더밸류뉴스]
전임상 시험에서 YH32364는 EGFR 발현 종양에서 기존 항-EGFR 항체인 세툭시맙보다 강한 항암 효과를 나타냈으며, 면역기억 반응을 통해 장기적인 항종양 효능을 유지하는 것으로 확인됐다. 또, 종양 미세 환경 내 면역세포 침윤을 유도하며, EGFR 의존적 4-1BB 자극 기전을 입증했다.
이번 임상은 사람 대상 첫 투약(first-in-human) 단계로, EGFR 과발현이 확인된 국소 진행성 또는 전이성 고형암 환자를 대상으로 YH32364의 안전성, 내약성, 약동학, 항종양 효과 등을 평가할 예정이다.
EGFR은 다양한 고형암에서 과발현되는 주요 표적으로, 기존 단일클론 항체(mAb)는 전이성 대장암 및 두경부 편평상피세포암 등에 일부 적용되고 있으나, 치료 효과가 제한적이라는 평가를 받아왔다. 유한양행은 YH32364가 보다 광범위한 EGFR 발현 고형암에 대해 면역세포 기반 작용을 통해 새로운 치료 가능성을 제시할 수 있을 것으로 기대하고 있다.
김열홍 유한양행 R&D 총괄 사장은 “고형암의 핵심 표적인 EGFR과 면역 환경을 조절할 수 있는 4-1BB를 결합한 이중항체 치료제로 임상에 진입하게 된 것은 의미 있는 진전”이라며 “유한양행 연구소가 수년간 최적화 및 전임상 개발에 집중한 결과”라고 밝혔다.
YH32364는 2018년 유한양행이 에이비엘바이오(ABL Bio)로부터 기술도입한 면역항암 파이프라인이다.
